
Los Hidróxidos y Ácidos
Los hidróxidos
Los hidróxidos son compuestos inorgánicos y ternarios que consisten de la interacción entre un catión metálico y el grupo funcional OH (anión hidróxido, OH–). La mayoría de ellos son de naturaleza iónica, aunque también pueden tener enlaces covalentes.
Por ejemplo, un hidróxido puede representarse como la interacción electrostática entre el catión M+ y el anión OH–, o como la unión covalente mediante el enlace M-OH (imagen inferior). En la primera se da el enlace iónico, mientras que en la segunda el covalente. Este hecho depende esencialmente del metal o catión M+, así como de su carga y radio iónico.
Debido a que gran parte de ellos provienen de los metales, resulta equivalente mencionarlos como hidróxidos metálicos.
¿Cómo se forman?
Existen dos rutas sintéticas principales: mediante la reacción del óxido correspondiente con el agua, o con una base fuerte en un medio ácido:
MO + H2O => M(OH)2
MO + H+ + OH– => M(OH)2
Únicamente aquellos óxidos metálicos solubles en agua reaccionan directamente para formar el hidróxido (primera ecuación química). Otros son insolubles y requieren de especies ácidas que liberen a M+, el cual interacciona seguidamente con los OH–provenientes de las bases fuertes (segunda ecuación química).
Sin embargo, dichas bases fuertes son hidróxidos metálicos NaOH, KOH y otros del grupo de los metales alcalinos (LiOH, RbOH, CsOH). Éstos son compuestos iónicos altamente solubles en agua, por lo tanto, sus OH– están libres para participar en reacciones químicas.
Por otro lado, existen hidróxidos metálicos que insolubles y en consecuencia son bases muy débiles. Incluso algunos de ellos son ácidos, como ocurre con el ácido telúrico, Te(OH)6.
El hidróxido establece un equilibrio de solubilidad con el solvente a su alrededor. Si es el agua, por ejemplo, se expresa entonces el equilibrio como sigue a continuación:
M(OH)2 <=> M2+(ac) + OH–(ac)
Donde (ac) denota que el medio es acuoso. Cuando el sólido es insoluble, la concentración de OH disuelta es pequeña o despreciable. Por esta razón, los hidróxidos metálicos insolubles no pueden generar soluciones tan básicas como las de NaOH.
A partir de lo anterior puede deducirse que los hidróxidos exhiben propiedades muy diferentes, vinculadas con la estructura química y las interacciones entre el metal y el OH. Así, aunque muchos sean iónicos, con estructuras cristalinas variadas, otros en cambio presentan estructuras poliméricas complejas y desordenadas.
Propiedades de los hidróxidos
Anión OH–
El ion hidroxilo es un átomo de oxígeno enlazado covalentemente a un hidrógeno. Así, éste puede representarse fácilmente como OH–. La carga negativa se ubica sobre el oxígeno, haciendo de este anión una especie donadora de electrones: una base.
Si el OH– dona sus electrones a un hidrógeno, se forma una molécula de H2O. También puede donar sus electrones a especies de carga positiva: como los centros metálicos M+. Así, se forma un complejo de coordinación a través del enlace dativo M–OH (el oxígeno aporta el par de electrones).
Sin embargo, para que suceda esto el oxígeno debe ser capaz de coordinarse eficientemente con el metal, de lo contrario, las interacciones entre M y OH tendrán un marcado carácter iónico (M+ OH–). Como el ion hidroxilo es el mismo en todos los hidróxidos, la diferencia entre todos ellos radica entonces en el catión que lo acompaña.
Asimismo, debido a que este catión puede proceder de cualquier metal de la tabla periódica (grupos 1, 2, 13, 14, 15, 16, o de los metales de transición), las propiedades de tales hidróxidos varían enormemente, aunque todos contemplan en común algunos aspectos.
Carácter iónico y básico
En los hidróxidos, aunque posean enlaces de coordinación, poseen un latente carácter iónico. En algunos, como el NaOH, sus iones forman parte de una red cristalina constituida por cationes Na+ y aniones OH– en proporciones 1:1; es decir, por cada ion Na+ hay un ion OH– de contraparte.
Dependiendo de la carga del metal, habrá más o menos aniones OH– a su alrededor. Por ejemplo, para un catión metálico M2+ habrá dos iones OH– interaccionando con él: M(OH)2, lo que se bosqueja como HO– M2+ OH–. Del mismo modo ocurre con los metales M3+ y con otros de cargas más positivas (aunque raras veces superan a 3+).
Este carácter iónico es responsable de muchas de las propiedades físicas, como los puntos de fusión y ebullición. Éstos son altos, lo cual refleja las fuerzas electrostáticas que obran dentro de la red cristalina. Asimismo, cuando los hidróxidos se disuelven o se funden pueden conducir la corriente eléctrica debido a la movilidad de sus iones.
Sin embargo, no todos los hidróxidos presentan iguales redes cristalinas. Aquellos con las más estables, serán menos propensos a disolverse en solventes polares como el agua. Como regla general, mientras más dispares sean los radios iónicos de M+ y OH–, más solubles serán los mismos.
Tendencia periódica
Lo anterior explica por qué la solubilidad de los hidróxidos de los metales alcalinos aumenta conforme se desciende por el grupo. Así, el orden creciente de solubilidades en agua para éstos es el siguiente: LiOH<NaOH<KOH<RbOH<CsOH.
El OH– es un anión pequeño, y a medida que el catión se vuelve más voluminoso, la red cristalina se debilita energéticamente.
Por otro lado, los metales alcalinotérreos forman hidróxidos menos solubles debido a sus mayores cargas positivas. Esto se debe a que el M2+ atrae con mayor fuerza a los OH– en comparación con M+. Igualmente, sus cationes son más pequeños, y por tanto menos desiguales en tamaño respecto al OH–.
El resultado de esto es la evidencia experimental de que el NaOH es mucho más básico que el Ca(OH)2. El mismo razonamiento puede aplicarse para otros hidróxidos, ya sea para los de los metales de transición, o para los de los metales del bloque
¿Qué es un ácido?
Un ácido es una sustancia que es capaz de liberar iones de hidrógeno en una solución. Además, también se considera como ácido un compuesto molecular que puede recibir un par de electrones.
La palabra ácido proviene del latín acidus, que significa ‘agrio’ o ‘afilado’, y se refiere al sabor desagradable de ciertas sustancias (por ejemplo, el vinagre).
Sin embargo, es importante señalar que existen diversas teorías utilizadas para definir lo que es un ácido.
Ácidos fuertes y débiles
Los ácidos se pueden considerar fuertes o débiles según como se disocien en un medio acuoso, es decir, según la cantidad de iones de hidrógeno que liberan en una solución.
Un ácido es fuerte cuando se ioniza fácilmente, es decir, la gran mayoría de sus iones de hidrógeno o protones son cedidos en solución. Estos ácidos son altamente corrosivos y buenos conductores eléctricos.
Entre los ácidos fuertes están el ácido sulfúrico H2SO4, el ácido bromhídrico (HBr) y el ácido clorhídrico (HCl).
En contraposición, los ácidos débiles son aquellos que no liberan una gran cantidad de iones de hidrógeno y son menos corrosivos que los ácidos fuertes. Ejemplos de ácidos débiles son el ácido carbónico (H2CO3) y el ácido acetilsalicílico (C9H8O4).
Propiedades de los ácidos
- Son altamente solubles en agua.
- Reaccionan con algunos metales.
- Funcionan como conductores de corriente eléctrica.
- Poseen sabor agrio (limón, por ejemplo).
- Cambian el color del papel tornasol del azul al rojo.
- Pueden destruir tejidos orgánicos.
- Reaccionan con bases, produciendo agua y sal.
- Las reacciones ácido-base son exotérmicas (liberan calor).
Ejemplos de ácidos
- Ácido ascórbico (vitamina C).
- Ácido cítrico, presente algunas frutas.
- Ácido acético (vinagre y vino).
- Ácido láctico, producido durante el ejercicio anaeróbico.
- Ácido acetilsalicílico (aspirina).
- Ácido clorhídrico (jugo gástrico).
- Ácido sulfúrico.
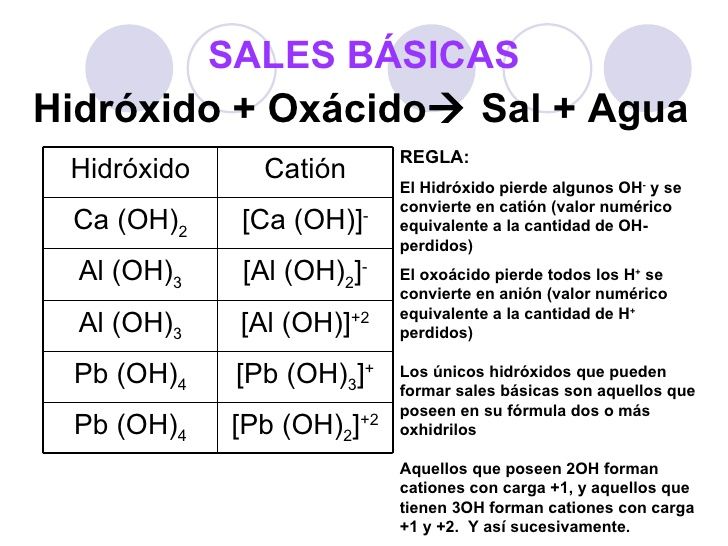
Tomado De: https://www.youtube.com/watch?v=hMiKZpiTQpY

No hay comentarios.:
Publicar un comentario